5-FU 标准曲线方程、检测限、 回收率和精密度 5-FU 浓度(C)与峰面积(A)呈良好的线性关系,回归方程为y=0.063x + 0.174。5-FU 最低检测限为 0.01 mg/L。5-FU 高、中、低3种储备 液血清浓度的回收率均高于95%,日内和日间相对标准差均低于5%。
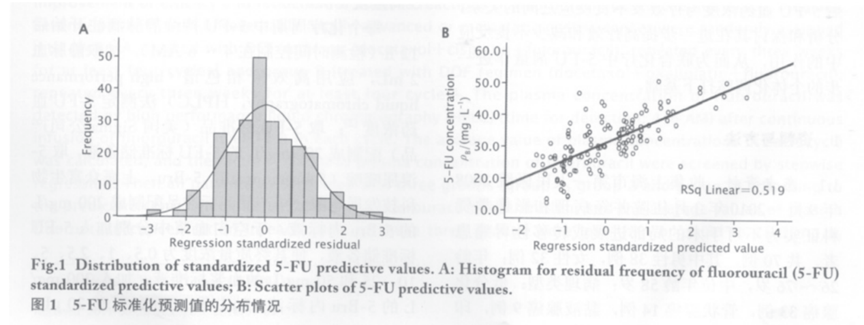
5-FU血药浓度与各影响因素的逐步回归分析以5-FU血药浓度为因变量,近期疗效、PFS、OS和不良反应为自变量进行逐步回归,发现5-FU血药浓度与骨髓抑制、黏膜炎、PFS 及 OS 相关(回归方程系数见表 1),5-FU 标准化预测值的残差频率呈正态分布(图 1A),5-FU 预测值呈线性分布(预测值的散点图及回归线见图 1B)。
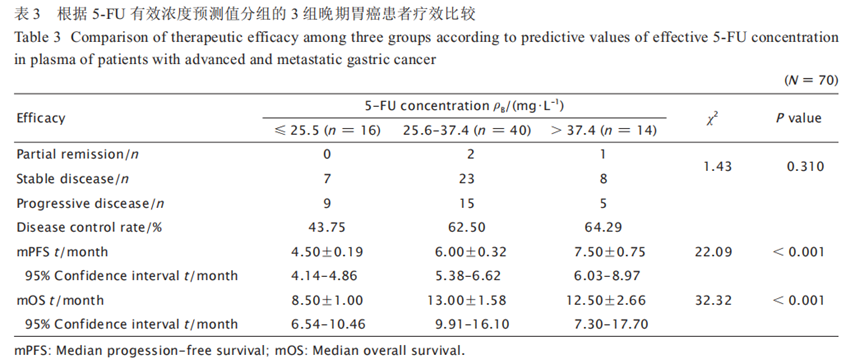
5-FU血药浓度与化疗疗效间的关系根据5-FU有效浓度预测值将患者分为≤ 25.5 mg/L、25.6~37.4 mg/L及> 37.4 mg/L 3组,3组间的临床特征差异无统计学意义(表2)。3组的 5-FU平均血药浓度分别为(20.73±3.80)、(31.98±3.10)和(40.32±3.45)mg/L(χ2=66.24,P < 0.001)。
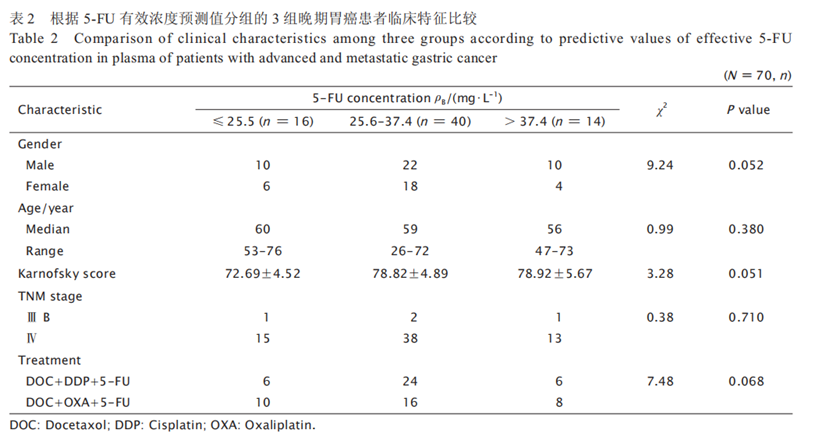
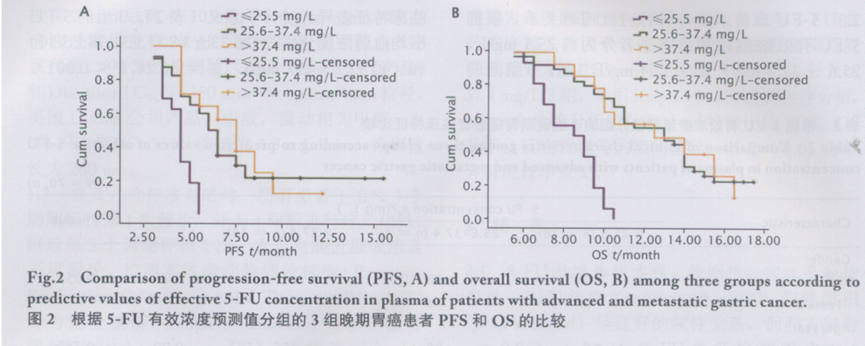
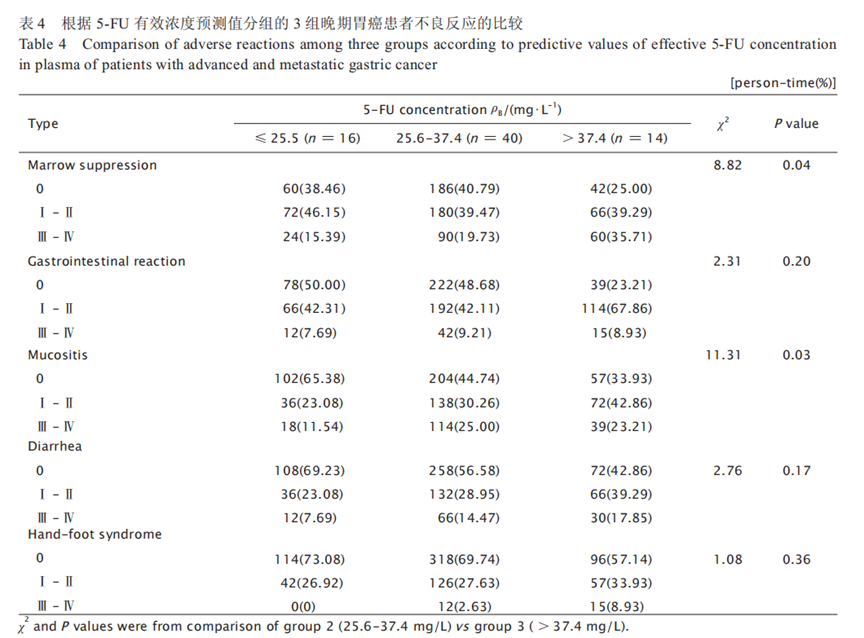
3 组的疾病控制率(disease control rate,DCR) 分别为 43.75%、62.50% 和 64.29%,第2、3 组 的 DCR 分别较第1组提高42.85%和46.95%,中位无进展生存期(median progressionfree survival,mPFS)分别较第1组提高 1.5 和3个月(χ2 = 22.09,P<0.001),中位总生存期(median overall survival,mOS)分别较第1组提高4.5和4个月(χ2 = 32.32,P<0.001)。3 组的疗效比较结果见表3和图2。5-FU血药浓度与化疗后不良反应间的关系根据 5-FU 有效浓度预测值将患者分为≤ 25.5 mg/L、25.6 ~ 37.4 mg/L 及> 37.4 mg/L3 组,化疗后比较3组患者的不良反应情况,结果(表4)显示: 第 2 和 3 组在胃肠系统反应、腹泻和手足综合征的发生率上差异无统计学意义,而在骨髓抑制和黏膜炎的发生率上第 3 组明显高于第 2 组(χ2=8.82,P=0.04 ;χ2=11.31,P= 0.03)。