治疗药物监测 ( therapeutic drug monitoring,TDM) 是指在临床进行药物治疗过程中,观察药物疗效的同时,定时采集患者的体液(如血液、尿液、唾液等) ,测定其中的药物或其代谢产物的浓度,探讨药物在体内的生物转化过程以及药物浓度的安全范围,并以药动学和药效学理论为基础,借助先进的分析技术与电子计算机手段,设计最佳给药方案 (药物剂量、给药途径、用药间隔等) ,实现个体化用药。TDM 旨在指导患者合理用药,以期达到安全、有效、经济的用药目标。大部分临床药效指征明显或毒性小的药物无需进行 TDM。目前,国内外进行 TDM 的药物主要有抗生素、抗病毒、抗肿瘤药物以及心血管类、神经精神类和免疫抑制类药物。抗肿瘤药物的治疗指数低,毒性相对较大,体内吸收、分布、代谢和排泄过程存在广泛的个体差异。癌症患者的治疗方案需要不断改进,联合用药种类繁多,治疗效果与患者的基础体征关系密切。因此,抗肿瘤药物在临床应用时有必要进行治疗药物监测。本文将从治疗药物监测的研究进展、抗肿瘤药物的应用特点以及治疗药物监测在抗肿瘤药物中的临床应用 3 个方面进行综述。
传统的细胞毒类药物和与分子靶向药物是当今临床抗肿瘤药物治疗的主导。然而,临床上肿瘤患者接受药物治疗的风险依然很高。这主要是由于药物的疗效不佳、毒性过大以及耐药性造成的。抗肿瘤药物的特殊性导致了治疗药物监测的必要性。
首先,抗肿瘤药物的治疗指数低,安全范围窄,用药时容易出现药量不足或过量中毒的现象。其次,血药浓度与药效和毒性的相关性强,药时曲线下的面积( area under concentration-time curve,AUC) 与稳态血药浓度 ( steady state plasma concentration,Css) 比给药剂量更能反映药效和毒性。第三,药效和毒性不宜直接观察和甄别,比如化疗药物通常需要服用多个周期才能判断是否有效,铂类药物的神经毒性具有蓄积作用,且某些抗癌药物也有致癌作用等。第四,肿瘤属于重症疾病,其给药方案与患者的心、肝、肾等脏器的功能水平密切相关,其治疗效果将直接决定患者的生存质量甚至预期寿命。上述特点表明,抗肿瘤药 物需要密切监测并及时调整血药浓度,同时要结合患者自身体征制定个体化的用药方案,TDM无疑将发挥重要作用。
药物相互作用是指两种或两种以上的药物同时应用时所发生的药动学和药效学变化。药动学方面,某些药物能调节P-糖蛋白( P-glycoprotein,P-gP) 和细胞色素 P450 酶( cytochrome P450,CYP450) 系统,从而影响其他药物的吸收、分布、代谢和排泄。药效学方面,不同药物在作用机制上存在相加、协同或拮抗,从而影响药效或毒性。肿瘤患者的用药往往有多种,这主要是由于: ① 抗肿瘤药物的给药方案经常涉及多药联合。② 抗肿瘤药物的毒副作用较大,需要同时服用其他药物进行调节。③ 肿瘤患者的其他基础病也需要服用药物。研究发现,60% 左右的肿瘤患者至少存在一种以上的基础疾病以及一次以上的药物相互作用风险。因此,制定肿瘤患者的给药方案要充分考虑到患者和药物等个体化因素,并且根据 TDM 的结果随时调整方案。肿瘤患者往往还需服用精神类、心血管类、抗生素类、镇痛类以及抗凝类药物,抗肿瘤药物与这些药物的相互作用详见表 1。

TDM 的临床应用主要建立在药物的药效学和药动学研究基础之上。因而,在临床上寻找抗肿瘤药物的适宜的药动学参数范围就显得尤为重要。报道显示,甲氨蝶呤、氟尿嘧啶类、紫杉醇和伊马替尼等抗肿瘤药物的药动学和药效学关系已经比较明确,临床 TDM 也比较成熟,可以用于指导临床用药。同时,其他药物的 TDM 还有待进一步研究。
MTX 的治疗指数较低,患者用药时药效与毒性反应容易同时出现。大剂量使用 MTX 时需配合甲酰四氢叶酸钙 ( calcium folinate,CF) 解救疗法,CF 解救剂量和时间应依据患者 MTX 血药浓度而定。研究表明,当 MTX 的血药浓度在给药后 24 h 仍高于5 μmol·L-1或给药后 48 h 仍高于0.5 μmol·L-1时,应给予 CF 解救。
氟尿嘧啶类( fluorouracil,5-Fu)
众所周知,双氢嘧啶脱氢酶( dihydropyrimidine dehydrogenase,DPD酶) 的活性可影响 5-Fu 的代谢。但由于不能准确预测毒性,故 DPD 酶只能作为参考。报道显示,5-Fu 的毒性与血药浓度、AUC均关系密切: 当给药 5 d 后,若血药浓度大于 1.5 μmol·L-1,则患者白细胞明显降低; 一个治疗周期结束后,当 AUC 达到30 mg·L-1 ·h-1时,5-Fu 的毒性明显,而当 AUC 达到 29 mg·L-1 ·h-1时患者的寿命则能延长。卡培他滨( capecitabine) 在体内代谢为 5-Fu,故卡培他滨的毒性也与血药浓度密切相关。
紫杉醇是治疗妇科肿瘤的常用药物。临床证实,Taxol 治疗卵巢癌时,其血药浓度大于 0.05 μmol·L-1 的时程与肿瘤完全缓解( complete response,CR) 或部分缓解( partial response,PR) 的比例以及无进展生存期( progression-free survival,PFS) 成正相关; 作为 Taxol 常见的血液毒性,中性粒细胞减少的百分比与血药浓度大于 0.1 μmol·L-1 的时程显著相关; Taxol 联用表阿霉素后,其血药浓度大于 0.1 μmol·L-1 的时间会相应减少,毒副作用也相应下降。
伊立替康是喜树碱类似物,它在体内转化为有活性的 SN-38 后发挥抗癌作用,但同时也会伴有严重的血液毒性。活性 SN-38 通过肝脏 UGT1A1 转化为无活性的 SN38G,故 UGT1A1 的多态性会引起 SN-38 水平的变化。在临床用药时,通过检测 UGT1A1 的基因型以及 SN-38 的水平可以及时预测并发现与 CPT-11 相关的毒副作用。
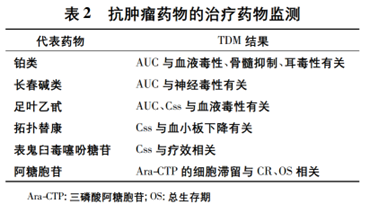
伊马替尼是用于治疗慢性髓性白血病 ( chronic myelognous leukemia,CML) 和恶性胃肠道间质肿瘤( gastrointestinal stromal tumor,GIST) 的常用靶向药物。研究发现,伊马替尼的临床疗效主要与其谷浓度密切相关。在 CML 的治疗中,伊马替尼谷浓度达到1170 ng·mL-1可以获得更好的治疗效果,但肌痛、皮疹、贫血和液体潴留的发生率也较高; 在 GIST 的治疗中,伊马替尼谷浓度达到 1110 ng·mL-1可以获得更长的 PFS。此外,针对其他抗肿瘤药物也已开展一系列 TDM 研究(见表 2)
由此可见,与经典药理学和分子生物学方法相比,TDM通过及时观测患者的血药浓度(如坪浓度、峰浓度、谷浓度以及AUC等) ,能更早为患者判断是否存在治疗失败、疗效不佳或过量中毒的风险。国外一篇研究 GIST 治疗的文献显示,医生为 GIST 患者选择靶向药物的过程分为 6 步: 疾病诊断、分期 分型、实施给药、浓度监测、疗效评价以及药物调整, 这与前文提到的治疗药物监测 7 步操作流程基本一致。
合理用药是指以药物和疾病的系统知识和理论为基础,安全、有效、经济、适当地为患者使用药物,以达到治疗、诊断和预防疾病的目的。WHO 发布的公告称,全球仍有 50% 的患者未能正确的使用药物。在我国,患者用药的种类、剂量、方式及配伍不当的现象还比较严重,因而导致疗效未达预期、不良反应和耐药性普遍发生。要想做到合理用药,除了需要严格遵守规章制度、全面掌握药品信息外,还必须充分考虑到患者的个体差异,通过治疗药物检测及时优化给药方案。前文提及的几类药物就是抗肿瘤药物合理应用的有力明证,但临床实践表明更广泛的研究还有待进一步展开。TDM 的前提条件是明确的量效(毒)关系,即建立血药浓度(或 AUC、峰谷浓度) 与疗效、毒性之间的关系。TDM 可以发现患者血药浓度的个体化差异,而药物基因组学可以预测患者的疗效和毒性,两者的有机结合是指导临床用药的前提保障(详见图 2) 。然而,TDM在实际应用中也遇到一些困难。首先,抗肿瘤药物需在体内转化为活性代谢物才能发挥作用,而血液中的活性代谢物比原型药物更难监测。其次,肿瘤组织中血管异常增生、血供特殊,体循环中监测到的血药浓度未必能真实反映肿瘤组织中的药物分布。再次,抗肿瘤药物的监测时程长,若用治愈率作为疗效评价标准,或者观察药物蓄积毒性,均需随访多年才能得到完整数据。第四,肿瘤治疗多采用联合给药,监测时难以区分单药的疗效及毒性,同时还要考虑药物的相互作用。最后,为了避免药物在患者体内产生毒性或抗药性,临床应用抗肿瘤药物时多采取间歇给药,有时难以达到稳态血药浓度,从而给监测带来困难。
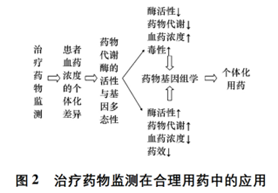
综上所述,由于抗肿瘤药物以及肿瘤患者的特殊性,TDM 在制订个体化用药方案的过程中发挥了重要作用,同时也面临严峻挑战。目前,国内的TDM研究还更多停留在理论层面,临床实践较少。只有在加强理论研究的基础上,不断深入临床实践,积累患者用药证据,并且与药物基因组学有机结合,才能切实做到为用药患者“量体裁衣”,保证抗肿瘤药物的合理使用。
1、采血时间点:一般为 24 小时,48 小时和 72 小时,但 24 小时给药方案 的初始采血点为给药结束后 36 小时或开始给药后 42 小时。
2、监测频率:正常代谢患者的监测频率为 3 次或 4 次;代谢延迟患者的监 测频率根据 MTX 的血药浓度,直到 MTX<0.1umol/L 即可停止监测。
1、采血时间点:采血时间为氟尿嘧啶静脉滴注开始后(24±6)小时,并应 准确记录静脉滴注开始,结束及采血时间。
2、监测频率:给药后监测 1 次(AUC)。
1、采血时间点:静脉输注后(24±6)小时。
2、监测频率:每个化疗周期输液时监测,以便于调整下一周期的剂量。
[1] 李润娥.抗肿瘤药物的治疗监测[J].临床合理用药,2014,7( 1) : 150 - 151.
[2] 钱新华,张能芳,高凌.抗肿瘤药物的治疗监测[J].江苏药学与临床研究,2003,11( 6) : 36 - 39.
[3] 兰静.治疗药物监测的概况及研究进展[J].天津药学,2010,22( 3) : 53 - 55.
[4] 魏新.治疗药物监测的方法学研究进展[J].安徽卫生职业技术学院学报,2010,9( 1) : 86 - 87,91.
[5] 谢吉科,姜德春.治疗药物监测的研究进展[J].中国药物应用与监测,2011,8( 6) : 379 - 382.
[6] GER RITSEN-VAN SCHIEVEEN P,ROYER B. Level of evidence for therapeutic drug monitoring of taxanes[J].Fundam Clin Pharmacol,2011,25( 4) : 414 -424.